
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
已知HCN的电离常数K=6.2×10-10,用物质的量都是0.1 mol的HCN和NaCN混合后配成1 L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
A.c(CN-)>c(Na+)
B.c(CN-) > c(HCN)
C.c(HCN)+c(CN-)=0.2 mol·L-1
D.c(CN-)+c(OH-)=0.1 mol·L-1
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.0.l mol·L-1的NaAlO2溶液:K+、Na+、SO42-、CO32-
B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO- 溶液中:K+、OH-、I-、SO32-
D.c(Al3+)=0.1 mol·L-1的溶液中:Na+、Cl-、AlO2-、SO42-
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.锌片插入硝酸银溶液中:Zn + Ag+=Zn2++Ag
B.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.碳酸氢钙溶液加到醋酸中:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
下图所示的实验,能达到实验目的的是 ( )
A | B | C | D |
|
|
|
|
验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )

A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:选择题
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是( )
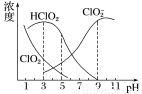
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:简答题
海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。
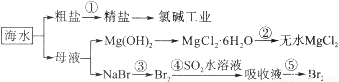
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的_________。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为__________(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2,应如何操作____________________。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将__________转化为_________的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为_____________
(5)从第③步到第④步的目的是____________________。采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收。主要反应的化学方程式为______________________________。
查看答案和解析>>
科目: 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:简答题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH = a kJ ?mol-1
2Fe(s)+3CO2(g) ΔH = a kJ ?mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ ?mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ ?mol-1
则a = kJ ?mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
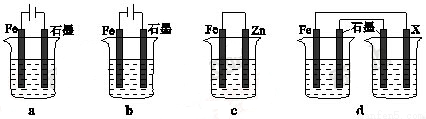
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com