
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
下列物质属于不等电子体的是
A. CH4和NH4+ B. B3H6N3和C6H6
C. CO2、N2O D. H2O和CH4
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
下列各组元素性质的递变情况错误的是
A. Li、Be、B原子最外层电子数依次增多
B. N、O、F电负性依次增大
C. P、S、Cl元素最高正价依次升高
D. Na、K、Rb第一电离能逐渐增大
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5
则下列有关比较中正确的是
A.第一电离能:③>②>①
B.原子半径:③>②>①
C.电负性:③>②>①
D.最高正化合价:③>②>①
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝
色透明溶液。下列对此现象的相关说法不正确的是
A.沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+
B.向反应后的溶液中加入乙醇,有沉淀析出
C.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对
D.反应前后,Cu2+浓度不变
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是
元素 | I1 | I2 | I3 | I4 |
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:选择题
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是
A. X:3s23p1Y:3s23p5
B. X:2s22p3Y:2s22p4
C. X:3s23p2Y:3s23p4
D. X:3s2Y:2s22p3
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:填空题
(1)p电子的原子轨道呈_______形;
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是 ,最高价氧化物对应的水化物的化学式
(4)用“>”或“<”填空:①能量:4P 5S ②离子半径:F- Na+
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:填空题
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:填空题
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高二下学期期末化学试卷(解析版) 题型:填空题
不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
第二周期 Li Be B C N O F
电负性值 0.98 1.57 2.04 2.55 3.44 3.98
第三周期 Na Mg Al Si P S Cl
电负性值 0.93 1.61 1.90 2.19 2.58 3.16
(1)通过分析x值的变化规律,确定Mg、N的x值的范围: <x(Mg)< ,
<x(Mg)< 。
(2)推测x值与原子半径的关系是 .根据短周期元素x值变化特点,体现了元素性质的
变化规律.
(3)某有机物结构简式如图,其中C﹣N中,你认为共用电子对偏向 原子(填原子名称).
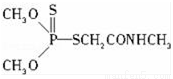
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为
(5)预测元素周期表中x值最小的元素是 (填元素符号,放射性元素除外).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com