
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
下列有关化学研究的正确说法是
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 对于同一个化学反应,无论是正反应还是逆反应,其反应的焓变相同
C. 根据11~17号元素最高价氧化物对应水化物的酸碱性递变规律,推出同周期元素的金属性、非金属性递变规律
D. 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34 g/mol,则下列说法中不正确的是
| X | Y |
|
Z |
| W | Q |
A.阴离子还原性:W>Q
B.X的最低价氢化物能形成分子间氢键
C.Z能在自然界中以游离态存在
D.Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式,下列判断正确的是
(i)H2(g)+ I2(g) 2HI(g);△H= -9.48kJ/mol
2HI(g);△H= -9.48kJ/mol
(ii)H2(g)+ I2(s) 2HI(g);△H= +26.48kJ
2HI(g);△H= +26.48kJ
A.1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol I2(s)升华,吸热17.00 kJ
 C.反应(i)的产物比反应(ii)的产物稳定
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
关于如图所示转化关系(X代表卤素),说法正确的是
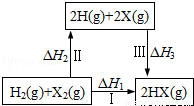
A.H2(g)+ X2(g)===2H(g)+ 2X(g) △H2>0
B.生成HX的反应热与途径有关,所以△H1≠△H2 + △H3
C.若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多
D.△H1代表H2的燃烧热
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
对于可逆反应2SO2(g)+ O2(g) 2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是
2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是
A.充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快
B.反应进行的净速率是正、逆反应速率之差
C.O2的消耗速率与SO3的生成速率之比为2:1
D.加入SO2,可使单位体积内活化分子百分比增多,加快反应速率
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.无论如何增大H2浓度,都不能使N2转化率达到100℅
D.缩小体积,υ正增大,υ逆减小,平衡正向移动
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
已知有反应:2A(g)+B(g) 3C(g);△H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
3C(g);△H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项 | X | Y |
|
A | 温度 | 容器内混合气体的密度 | |
B | A的物质的量 | B的转化率 | |
C | 催化剂的质量 | C的体积分数 | |
D | 加入Ar的物质的量 | 逆反应速率 |
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g) xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
查看答案和解析>>
科目: 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:推断题
X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 |
|
|
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com