
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入 盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)= c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32-
B.向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO=3Br2+2NO↑+4H2O
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.双氧水使酸性KMnO4溶液褪色:2MnO+5H2O2=2Mn2++5O2↑+6OH-+2H2O
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
全钒液流电池足一种新型的绿色环保储能电池。其电池总反应为:V3++VO2++H2O 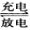 VO2++2H++V2+,下列说法正确的是
VO2++2H++V2+,下列说法正确的是
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.充电时阴极反应为:V2+-e-=V3+
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
CuCO3 和Cu2(OH)2CO3的混合物34.6 g,可恰好完全溶解于300mL、2 mol·L-1的盐酸溶液中,若加热分解等量的这种混合物可得CuO固体质量为
A.16.0 g B.19.2 g C.24.0 g D.30.6 g
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:实验题
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。
反应原理:
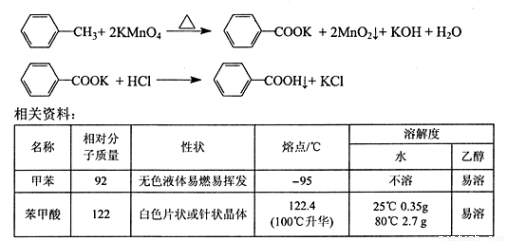
实验步骤:
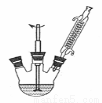
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。

②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:填空题
高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
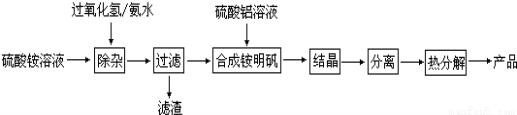
根据上述流程图填空:
(1)“除杂”操作是先加入过氧化氢充分反应后,再用氨水调节溶液的pH,使硫酸铵溶液中的少量Fe2+氧化为Fe3+并进一步转化为Fe(OH)3从而除去Fe2+,则Fe2+酸性条件下氧化为Fe3+的离子方程式为: 。
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(4)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,铵明矾属于 (填“纯净物”或“混合物”)在0.1mol/L铵明矾的水溶液中,浓度最大的离子是 。
(5)热分解中发生如下反应6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 9H2O,当生成1mol Al2O3时转移电子物质的量为 mol;
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,反应的总离子方程式为: 。
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:填空题
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g)  N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
查看答案和解析>>
科目: 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:实验题
G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线如下(部分产物和部分反应条件略去):


已知:
①B中核磁共振氢谱图显示分子中有6种不同环境的氢原子;
②D和F互为同系物。
请回答下列问题:
(1)(CH3)2C=CH2的系统命名法名称为 ,生成B这一步的反应类型为 。
(2)E的结构简式为 ,F分子中含有的含氧官能团名称是 。
(3)C经氧化后可得到一种能与新制银氨溶液发生银镜反应的物质,请写出该银镜反应的化学方程式 。
(4)F可在一定条件下合成高分子化合物,请写出该高分子化合物的结构简式 。
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②苯环上有两个取代基;③能与碳酸氢钠溶液反应放出气体;这样的D的同分异构体共有 种(不包括立体异构);
(6)请参照合成路线中苯乙烯合成F的方法,写出由1-丁烯制取2-羟基丁酸 的合成线路: 。
的合成线路: 。
查看答案和解析>>
科目: 来源:2015-2016学年甘肃省高一上期末化学试卷(解析版) 题型:选择题
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌
②给试管里的液体药品加热时,应将试管倾斜,与桌面成45°,并集中在药品处加热
③使用金属钠或钾时,用剩的药品要放回原试剂瓶中
④镁着火时使用二氧化碳扑灭
⑤夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风
⑥废旧电池应回收处理
A. 全部 B. ①②④⑤ C. ①③⑤ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com