
科目: 来源:2015-2016学年辽宁省抚顺市协作校高一下期末化学试卷(解析版) 题型:填空题
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
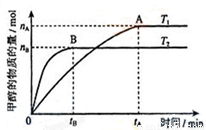
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的均解释正确的是
选项 | 现象或事实 | 解释 |
A. | 在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 | 钢铁闸门与锌块在海水中构成原电池,钢铁闸门作正极 |
B. | 某些抗氧化剂作食品添加剂 | 抗氧化剂与食品反应,延缓食品腐败速率 |
C. | 用热的烧碱溶液洗去油污 | Na2CO3可直接与油污反应 |
D. | 明矾可作漂白剂 | 明矾电离出的Al3+水解时产生具有吸附性的胶体粒子 |
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.1L 1 mol•L﹣1的Fe2(SO4)3 溶液加热蒸干得到Fe(OH)3胶体粒子的数目为2NA
B.室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
C.0.1 L 0.5 mol•L﹣1 CH3COOH溶液中含有的氢离子数目小于0.05NA
D.电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64 g
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
下列实验的反应原理用方程式或电极反应式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
C.用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.铅酸蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-= PbO2+4H++SO42-
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L﹣1•min-1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变。
A. ①②④ B. ①③⑤ C. ②③④ D.③④⑤
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是
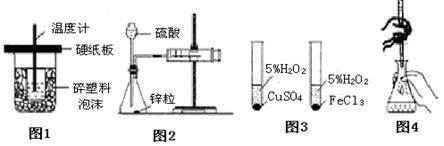
A. 图1装置用于中和热的测定
B. 图2装置用于测定氢气的反应速率(单位mL/s)
C. 图3装置用于研究催化剂Cu2+和Fe3+对反应速率的影响
D. 图4装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
已知水的电离方程式:H2O ? H++OH-。下列叙述中,正确的是
A.向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变
B.降低温度,KW减小,pH不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
B.已知强酸与强碱在稀溶液里反应的中和热为57.3 kJ·mol-1, 则1/2 H2SO4(aq)+1/2 Ba(OH)2(aq)= 1/2BaSO4(s)+H2O(l) ΔH= -57.3 kJ·mol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
D.已知25℃、101KPa条件下:4Al(s)+3O2(g)=2A12O3(s) △H=-2834.9 kJ·mol-1,
4Al(s)+2O3(g)=2A12O3(s) △H=-3119.1 kJ·mol-1, 则O2比O3稳定
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
下表离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ═Fe(OH)3↓ |
B | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl 2溶液 | SO42ˉ+Ba2+═BaSO4↓ |
C | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ═Al(OH)3↓ |
D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
查看答案和解析>>
科目: 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g)  N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)  2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)  2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com