
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:选择题
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲酸(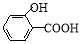 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( )存在分子间氢键。则两者的熔点、沸点的相对大小关系是
)存在分子间氢键。则两者的熔点、沸点的相对大小关系是
A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:选择题
实验测得-25℃时干冰晶体(面心结构)的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)
A.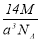 B.
B.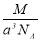 C.
C.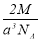 D.
D.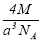
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:填空题
(1)用”>”、”<”填写下表
第一电离能 | 电负性 | 晶格能 | 沸点 |
O N | Cl F | NaCl CaO | HF HCl |
(2)白磷(P4)和P4O6的分子结构如图。现提供以下化学键的键能:P—P为E1kJ·mol—1、P—O为E2kJ·mol—1、O=O为E3 kJ·mol—1。则:P4(s)+3O2(g)==P4O6(s)的反应热△H= kJ·mol—1
(用E1,E2,E3表示)。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:填空题
(1)氟化氢水溶液中存在的氢键有 种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有___个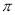 键;
键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有___种能量不同的电子;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③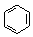 、④HCHO等,其中碳原子不是采取sp2杂化的分子有______(填物质编号),HCHO分子的立体构型为____。
、④HCHO等,其中碳原子不是采取sp2杂化的分子有______(填物质编号),HCHO分子的立体构型为____。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:填空题
(1)含碳物质不完全燃烧会产生剧毒的CO,根据价键理论,CO的电子式为 ,结构式为 。
(2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(俗称“次氟酸”)以来,对HFO的研究引起重视。
①HFO的电子式为 ,则HFO的结构式为 (在HFO的结构式中标出各元素的化合价)。
②对比其它次卤酸可以看出,把HFO称着“次氟酸”其实不妥当的,理由是 。
③次氟酸能与水反应生成两种物质,其中有一种物质为HF(常用于雕刻玻璃),则次氟酸与水反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:填空题
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等。
乙炔法: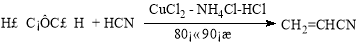
丙烯氨氧化法: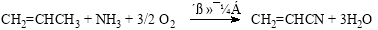
(1)下列说法正确的是 (不定项选择):
a.NH4+空间构型呈正四面体
b.CH2=CHCN分子中只有碳、氢原子位于同一平面
c.C2H2、HCN分子中所有原子均位于同一直线
d.NH3极易溶于H2O,是因为它们都是极性分子
(2)与NH3互为等电子体的阳离子为 (写化学式)。
(3)1mol丙烯腈分子中含有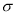 键的数目为 。
键的数目为 。
(4)铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成。
①该反应的化学方程式为 。
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为 。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:推断题
A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n-l)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是 ;E元素的元素符号为 ,它能形成E+的原因为 。
(2)D元素基态原子的核外电子轨道排布图为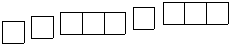 。
。
(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,原因是 ;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:推断题
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态。
(1)①在元素周期表中,元素X位于 区,元素Y位于第 周期第 族。
②Z所在周期中,第一电离能最大的元素是 (填元素名称)。
③X+的核外电子排布式为 。
④Y和W两元素最高价氧化物对应的水化物酸性较强的是 (填化学式)。
(2)X与Y所形成化合物晶体的晶胞如图所示。在1个晶胞中,X离子的数目为 ;该化合物的化学式为 。
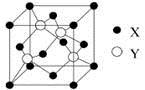
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是 。
②稳定性: H2Z H2W(填“>”、“<”或“=”),其主要原因是 。
查看答案和解析>>
科目: 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:计算题
如果1 mol金属R的质量为a g,密度ρ="0.97" g·cm-3,请计算出每个R原子的半径的表达式(设钠为紧密堆积结构,见图)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com