
科目: 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:填空题
现有如下溶液:
①1.0mL0.10mol•L-1双氧水
②1.0mL0.20mol•L-1双氧水
③3.0mL0.10mol•L-1KMnO4溶液
④3.0mL0.010mol•L-1KMnO4溶液。
所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)写出发生反应的离子方程式_________________________;若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为______________,若有9molH2O2参加该反应,则反应转移电子数目为___________;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂______进行实验(填序号)。
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为___________;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象。为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因___________;
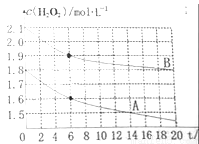
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则_____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是___________;
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:填空题
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g) CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
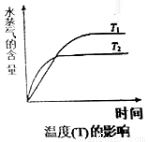
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
水是最宝贵的资源之一。下列表述正确的是
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1 L庚烷所含有的分子数为NA/22.4
B.1 mol甲基(—CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA
D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同,下列事实不能说明上述观点的是
A.苯酚能与NaOH溶液反应,乙醇不能与NaOH溶液反应
B.甲苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色
C.乙烯能发生加成反应,乙烷不能发生加成反应
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
下列各操作中,正确的是
A. 为减缓反应速率,用饱和食盐水与电石反应制乙炔
B. 进行酸碱中和滴定时,锥形瓶应用待测液润洗
C. 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸
D. 配制FeCl3溶液时,加入少量稀硫酸抑制其水解
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
常温下下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+
C.c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42—、SCN-
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
对于0.1mol·L-1 Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+ c(HSO3-)+ c(H2SO3)
C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的“原子经济性”反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A.乙烯与氧气在银催化作用下生成环氧乙烷( )
)
B.乙烷与氯气制备氯乙烷
C.苯和乙醇为原料,在一定条件下生产乙苯
D.乙醇与浓硫酸共热制备乙烯
查看答案和解析>>
科目: 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
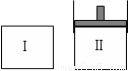
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
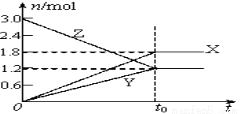
A.该反应的化学方程式为:3X+2Y 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com