
科目: 来源:2017届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
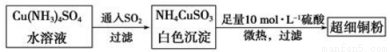
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
下列物质的用途是应用其化学性质的是( )
A.用铁罐储存浓硝酸 B.用MgO、Al2O3制作耐高温坩埚
C.用铁芯铝绞线作为高压输电线材料 D.用钠钾合金作为快中子反应堆的热交换剂
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
已知某有机物(分子式为C5H10O2)能发生水解反应生成甲和乙,乙能与氧气在催化剂Cu的作用下反应生成丙。若甲、丙都不能发生银镜反应,则符合条件的该有机物有(不考虑立体异构)
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
下列图示实验(夹持装置省略)正确的是
A. 配制溶液时进行定容 B. 实验室制备NO
B. 实验室制备NO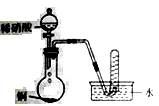
C. 制备氢氧化亚铁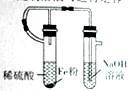 D. 收集SO2,并吸收多余的SO2
D. 收集SO2,并吸收多余的SO2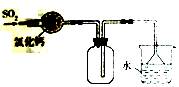
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
X、Y、Z、W、Q均为短周期主族元素,且原子序数依次增大。工业上常通过分离液态空气获得X的单质;Y与X形成的一种化合物是汽车尾气的主要成分之一;常温下,Z的块状单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其冷的浓溶液。下列说法正确的是( )
A. 元素Y的最高正化合价为+6 B. 简单离子半径大小顺序为W>Q>Z>X>Y
C. 简单气态氢化物的稳定性:Y>W D. X的简单气体氢化物分子与Q的简单离子具有相同的电子数
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
常温下,不考虑混合后溶液体积的变化,下列说法错误的是
A.0.1mol·L-1CH3COOH溶液加水稀释后,溶液中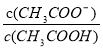 的值增大
的值增大
B.pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1%
C.amol·L-1H2C2O4溶液与2amol·L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-)
D.0.1mol·L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
2015年12月9日据英国《金融时报》网站报道,化学教授克莱尔·格雷和她的团队攻克了锂空气电池开发中的技术难关。锂空气电池工作原理示意图如下。下列说法正确的是

A.放电时,负极反应式为O2+4e-+2H2O=4OH-
B.充电时,阳极反应式为Li++e-=Li
C.电池充电反应为4LiOH=4Li+O2+2H2O
D.放电时消耗2molO2,转移电子数为4mol
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:选择题
室温下,将物质的量均为2mol的CH3OH(g)、CO(g)、H2(g)分别完全燃烧生成稳定化合物,热效应分别为△H1、△H2、△H3,CO(g)+2H2(g)  CH3OH(g)的热效应为△H4.则下列判断正确的是
CH3OH(g)的热效应为△H4.则下列判断正确的是
A.△H1>0
B.△H1=△H2+2△H3-△H4
C.△H3>△H4
D.2△H4+△H3<0
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:填空题
(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g)  CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
(4)在恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
查看答案和解析>>
科目: 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:实验题
(14分)某种废锂电池正极材料的主要成分是LiCoO2,含少量Al、Fe等,LiCoO2不溶于水。实验室回收废锂电池制备锂单质的流程如图所示:

(1)正极材料酸浸时发生主要反应的化学方程式为_______。某同学从环境保护的角度考虑上述做法不合理,理由是_______,于是提出可用酸化的双氧水代替盐酸,则反应的离子方程式为______。
(2)Li2CO3在高温焙烧时发生反应的化学方程式为______。
(3)固体C与焦炭的反应需在真空条件下进行的原因是_______。
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为______。如果用LiCl的水溶液代替熔融的LiCl-KCl,则其后果是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com