
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)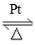 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与保护的说法正确的是
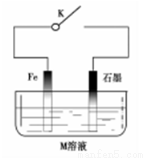
A.常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀
B.关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH-
C.关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑
D.关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
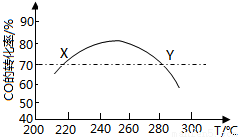
A.X、Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H>0
C.反应温度控制在240℃~260℃之间
D.选择合适催化剂,可以提高CO的转化率
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:填空题
锰及其化合物有广泛应用。
(1)在稀硫酸酸化的双氧水中加入二氧化锰粉末,产生大量气泡,且黑色固体消失;向反应完全后的溶液中加入高锰酸钾溶液生成黑色沉淀。经检测:1mol KMnO4完全反应转移3mol电子。在双氧水参与的反应中,二氧化锰除了作催化剂还作 ;写出加入高锰酸钾后产生黑色沉淀的离子方程式 。
(2)菱锰矿是生产铁锰合金中锰的来源,其主要成分是碳酸锰。已知锰常见的化合价有+2、+4、+6、+7。在空气中灼烧菱锰矿生产四氧化三锰,然后用铝热反应制备锰。写出菱锰矿粉末在空气中高温灼烧生成四氧化三锰的化学方程式 。如果冶炼1100kg锰,理论上消耗铝的质量为 kg。

(3)工业生产中为了制备硫酸锰,往往将硫酸锰溶液中亚铁离子氧化成铁离子,调节pH除去铁离子。向混合溶液中滴加稀硫酸酸化,加入软锰矿(主要成分是二氧化锰)氧化亚铁离子,写出该过程的离子方程式 。
(4)酸性高锰酸钾可氧化乙醇,配平下列反应方程式:
KMnO4+ H2SO4+ CH3CH2OH= K2SO4+ MnSO4+ CH3COOH+ □。
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:实验题
高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
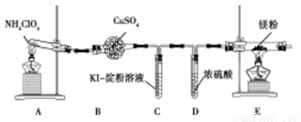
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
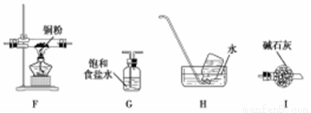
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:实验题
高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
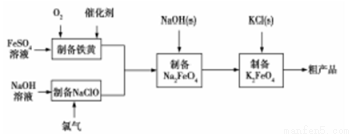
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式 。
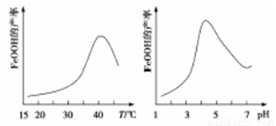
(2)制备铁黄的反应中氧化剂与还原剂的物质的量之比为 。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择 ;pH大于4.5时铁黄产率降低的主要原因可能是 。
(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3、CN-等,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式 。
(4)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:
2K2FeO4+3Zn+8H2O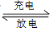 2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
(5)已知:常温下,Kap[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)= mol·L-1。
(6)如果上述流程中,铁元素总利用率为75%。利用1mol 2mol·L-1FeSO4溶液能制备纯度为90%的高铁酸钾 kg。
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:填空题
科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)  N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:CO燃烧热△H2=-283kJ·mol-1。几种化学键键能数据如下:
化学键 | N=N键 | O=O键 |
|
键能/kJ·mol-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g) △H3= ,上述△H1= 。
(2)CO——空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),则负极的电极反应式为 。
(3)2CO(g)+2NO(g) N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。
N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。
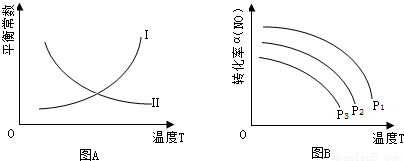
(4)当NO、CO的浓度比为1时,体系中NO平衡转化率(α)与温度、压强的关系如图B所示。α(NO)随着温度升高而 (填“增大”或“减小”),其原因是 。图B中,压强由小到大的顺序为 ,其判断理由是 。
查看答案和解析>>
科目: 来源:2017届黑龙江省高三上学期第一次质检化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.同温同压下,相同体积的物质,所含的粒子数必相等
B.等体积、等物质的量浓度的强酸中所含的H+数目一定相等
C.1 L一氧化碳气体的质量一定比1 L氧气的质量小
D.任何条件下,等质量的乙烯和一氧化碳所含的分子数必相等
查看答案和解析>>
科目: 来源:2017届黑龙江省高三上学期第一次质检化学试卷(解析版) 题型:选择题
下列有关物质用途的说法中,不正确的是
A.氢氟酸可用来刻蚀玻璃 B.过氧化钠常用作供氧剂
C.晶体硅可用于制作光导纤维 D.漂白粉可用作游泳池的消毒剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com