
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示 ,符合图示情况的是( )
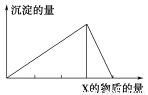
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:实验题
(1)写出CO2和Na2O2反应的化学方程式:_______________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?________,简要说明理由:__________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。

装置中B的作用是__________________,D的作用是_______________。
(4)为确认反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(选填序号)________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:实验题
Na2CO3的制取方法及综合实验探究
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
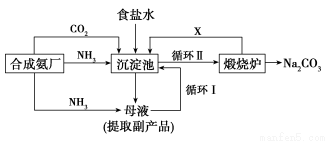
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是________________________。
②从生产流程图可知,可循环利用的物质是_____________。
③写出沉淀池中、煅烧炉中反应的化学方程式__________________。
(2)如何用CO2和50 mL 2 mol·L-1 NaOH溶液制取50 mL 1 mol·L-1 Na2CO3溶液?
①写出简要的实验步骤:_________________________________。
②写出有关反应的化学方程式:___________________________。
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:实验题
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:____________________。
②同学们在两烧杯中还观察到以下现象。其中盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
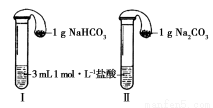
①两试管中均产生气体,________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是________(填字母序号)。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:________(写离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:填空题
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
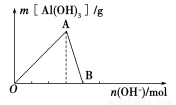
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:实验题
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S2Al2O3+________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________。
(2)“溶解”时反应的离子方程式为___________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_________________。
(4)“母液”中可回收的物质是__________________________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式是_________。
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:填空题
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:

(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①________和②________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为________。
(4)镀铝电解池中,金属铝为________极,熔融盐电镀液中铝元素和氯元素主要以AlCl 和Al2Cl形式存在,铝电极的主要电极反应式为___________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是___________________。
查看答案和解析>>
科目: 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:填空题
(2016·银川模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2 4AlCl3+3O2。
4AlCl3+3O2。
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是_____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2AlCl3+X↑,设计实验确定气体X的__________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:
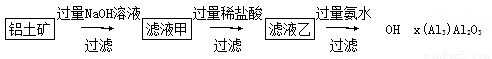
①写出滤液甲中溶质的化学式:___________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:__________________________。
③要进一步获得金属铝,工业上采用的冶炼方法是_______________,
有关反应的化学方程式为________________________。
查看答案和解析>>
科目: 来源:2017届山西省协作体高三暑假第一次联考化学试卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为为:S(s) + 2KNO3(s) + 3C(s) == K2S(s) + N2(g) + 3CO2(g) ΔH= x kJ·mol-1 。已知碳的燃烧热ΔH1 = a kJ·mol-1;S(s) + 2K(s) == K2S(s); ΔH2= b kJ·mol-1;2K(s) + N2(g)+3O2(g)==2KNO3(s); ΔH3= c kJ·mol-1 。则x为( )
A.3a+b-c B.c +3a-b C.a+b-c D.c+a-b
查看答案和解析>>
科目: 来源:2017届山西省协作体高三暑假第一次联考化学试卷(解析版) 题型:选择题
标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。则这两种混合气体可能为( )
A.H2与C2H4 B.CO与C2H4 C.CO 与C3H6 D.H2与C4H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com