
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸(HClO2为弱酸)不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
A.在酸性条件下,亚氯酸钠的氧化性增强
B.溶液中的Cl-起催化作用
C.ClO2逸出,使反应的生成物浓度降低
D.溶液中的H+起催化作用
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的有( )个
①.标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0.1NA
②.常温常压下,等物质的量的 N2与CO气体含有的原子数目均为NA
③.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
④.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
⑤.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
⑥.1 mol Fel2与足量氯气反应时转移的电子数为2NA
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
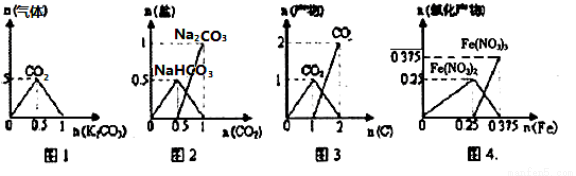
A.图l:n(HCl)=lmol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2逐步通人到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=lmol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
有BaCl2和NaCl的混合 溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO
溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO 3。据此得知原混合溶液中的c(Na+)/mol·L-1为( )
3。据此得知原混合溶液中的c(Na+)/mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 = 2KSCN + CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O
NaCl + 2O 2↑
2↑
下列说法不正确是 ( )
A.酸性(水溶液):HSCN > H2CO3 > HCN
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
下列化学反应先后顺序判断正确的是( )
A.在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I—、Br—、Fe2+
B.在含有等物质的量的NaOH、Ca(OH)2 、NaAlO2 的溶液中通入CO2气体:NaOH、Ca(OH)2 、NaAlO2
C.在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、A13+、Al(OH)3
D.在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ cCl2↑+ dHClO4 + eH2O用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的( )
A.由反应可确定:氧化性HClO4>HClO3
B.若化学计量数a=8,b=3,则该反应转移电子数为20e-
C.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12 + I2 + 6H2O = 12H+ + 8Cl-+ 2IO3-
D.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3=15O2↑+ 8C12↑+ 10HClO4 + 8H2O
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含有I—浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。
主要步骤如是:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2=4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶 液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2=Na2S4O6+2NaI
液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2=Na2S4O6+2NaI
经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设前后溶液体积相等)( )
A.2倍 B.4倍 C.36倍 D.16倍
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
下列各物质中,不能够按照 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )
物质 编号 | a | b | c |
1 | Al2O3 | NaAlO2 | Al(OH)3 |
2 | FeO | Fe(NO3)2 | Fe(OH)2 |
3 | MgCl2 | Mg(OH)2 | MgO |
4 | CuO | CuSO4 | Cu(OH)2 |
5 | Si | SiO2 | H2SiO3 |
6 | C | CO | CO2 |
A.1项 B.2项 C.3项 D.4项
查看答案和解析>>
科目: 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
实验室用含有杂质(FeO、 Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在pH=5时沉淀完全)。其中分析错误的是( )
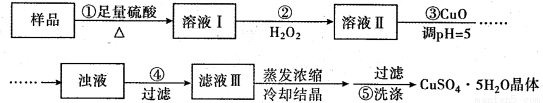
A.步骤②发生的主要反应为:2Fe2+ +H2O2 +2H+ = 2Fe3+ + 2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替 H2O2
C.步骤③用 CuCO3代替CuO也可调节溶液的pH
D.步骤⑤操作为:向漏斗中加少量冷的蒸馏水至浸没晶体,待水自然流下,重复2-3次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com