
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
某混合物含有氯化钠、碳酸钠和氯化钾。经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为
A. 20% B.30% C.45% D.55%
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是( )
A.Fe2O3与FeO的物质的量之比为1∶6
B.硝酸的物质的量浓度为3.0 mol/L
C.产生的NO在标准状况下的体积为4.48 L
D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:___________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2=S4O
+I2=S4O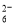 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是______________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是____________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:填空题
Ⅰ.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(2)写出实验②发生反应的离子方程式: 。
(3)C常用作净水剂,用离子方程式表示其净水原理: 。
Ⅱ.某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的若干种,取该溶液进行连续实验,实验过程及产物如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子有_____________肯定不存在的离子是_________________
(2)请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:____________________。
(3)写出反应①的离子方程式:________________。
(4)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C的物质的量大于0.7mol时,溶液X中还一定含有____________.
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:填空题
Ⅰ、氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式:____________________
(3)CuH溶解在稀盐酸中生成的气体是_________(填化学式).
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_________________________.
Ⅱ、某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(1)写出该反应的化学方程式:________________________;
(2)若有9.8 g H2SO4参加反应,则转移电子的物质的量为________;
(3)本反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果:________________。
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:实验题
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:

已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
下列有关放热反应、吸热反应的说法不正确的是( )
A.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
白磷与氧气可发生如下反应:P4+5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子 结构和有关数据估算该反应的ΔH,其中正确的是( )
结构和有关数据估算该反应的ΔH,其中正确的是( )

A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=﹣221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=﹣57.3kJ/mol.下列结论正确的是( )
A.碳的燃烧热小于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C. 浓硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJ/mol
浓硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )

A.稍过量的氢氧化钠是确保盐酸完全反应
B.仪器A的名称是环形玻璃搅拌棒
C.在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度
D.用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com