
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物
B.若生成4.48 L HF,则转移0.8 mol电子
C.还原剂与氧化剂的物质的量之比为1:4
D.O2F2既是氧化剂又是还原剂
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
用4种溶液 进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
选项 | 试剂和操作 | 现象 |
A | 向AlCl3溶液中滴入过量的氨水 | 溶液先有白色沉淀,后来沉淀消失 |
B | 向新生成的AgCl浊液中滴入KI溶液,振荡 | 白色沉淀逐渐转化为黄色沉淀 |
C | 向Ca(ClO)2溶液中先通入CO2,再加入少量品红溶液 | 溶液先变浑浊,通入CO2后品红的红色不褪去 |
D | 向BaCl2溶液中先通入SO2,再通入过量NO2 | 先生成沉淀,后来沉淀消失 |
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的
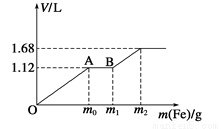
A.开始时产生的气体为H2
B.AB段产生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5mol·L-1
D.参加反应铁粉的总质量m2=5.6 g
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
xmL CO2通过足量的Na2O2后再与ymLNO混合,若x与y之和为30mL,充分反应后气体的体积缩小为15mL,则x不可能为
A.10 B.15 C.20 D.25
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g ,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A.3.2mol/L B.1.6mol/L C.0.9mol/L D.无法判断
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:简答题
按要求写出下列反应的离子反应方程式。
(1)用FeCl3溶液腐蚀敷有铜箔的线路板:
(2)向NaClO溶液中通入少量SO2:
(3)将Na投入到Ca(HCO3)2溶液中,反应后生成正盐溶液:
(4)明矾溶液中加入Ba(OH)溶液,沉淀质量最大时:
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:实验题
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。

(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:实验题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
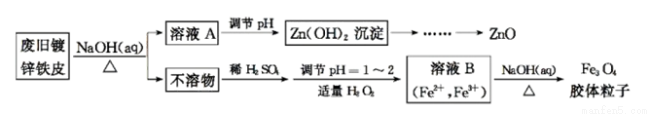
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有 。(填字母序号)
A.去除油污  B.溶解镀锌层 C.去除铁锈 D.钝化
B.溶解镀锌层 C.去除铁锈 D.钝化
(2)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是 。
(3)? (填“能”或“不能”)。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:实验题
某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是______________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为____________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
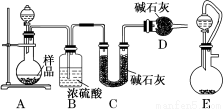
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是_____________________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是__________________________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确? (填“是”或“否”)。
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为 (保留两位有效数字)。
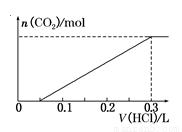
查看答案和解析>>
科目: 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:实验题
某化学兴趣小组进行了如下实验,取一支试管加入一定量的FeBr2溶液,再向其中滴加一定量的氯水,溶液变黄。根据反应现象,对反应后的溶液成分,推出以下几种可能:
①溶液中含有Fe3+,无Fe2+和Br2
②溶液中含有Fe2+和Fe3+,无Br2
③溶液中含有Fe2+、Fe3+和Br2
④溶液中含有Br2,无Fe3+
(1)结合实验现象和你的化学知识,你认为哪几种可能是正确的 (填序号)。
(2)要检验溶液中有哪些离子,分别取反应后的溶液进行如下操作:
①判断溶液中是否含有Fe3+,向溶液中加入KSCN溶液,判断溶液变化。你认为这种方法是否可靠? (填“可靠”或“不可靠”)。
②如果溶液中既含Fe2+又含Fe3+, (填“能”或“不能”)通过先加KSCN溶液,再滴加氯水的方法检验溶液中是否含有Fe2+;有人提出, 可以向溶液中滴加酸性KMnO4溶液,根据KMnO4溶液是否褪色来判断,该方法是否可靠 (填“可靠”或“不可靠”),理由是 ;还有人提出,滴加 溶液(填化学式)观察是否有蓝色沉淀可检验Fe2+。
可以向溶液中滴加酸性KMnO4溶液,根据KMnO4溶液是否褪色来判断,该方法是否可靠 (填“可靠”或“不可靠”),理由是 ;还有人提出,滴加 溶液(填化学式)观察是否有蓝色沉淀可检验Fe2+。
(3)如果将FeBr2改成FeI2,在100mL FeI2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Fe2+被氧化,写出实际所发生反应的离子方程式: ;FeI2溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com