
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:选择题
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1:6 B.1:7 C.2:11 D.16:25
查看答案和解析>>
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:填空题
减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按 =1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
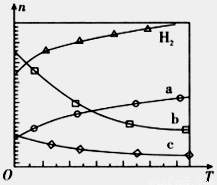
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
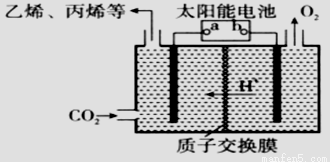
①该工艺中能量转化方式主要有_________。
②b为电源的________(填“正”或“负”)极,电解时,生 成乙烯的电极反应式是_________。
成乙烯的电极反应式是_________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。
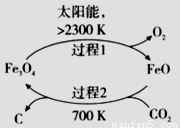
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
查看答案和解析>>
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:填空题
 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

 部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
| Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤液Ⅱ中可回收利用的主要物质有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是__________,若要得到MgCl2应采取的操作是___________。
(5)用稀硫酸酸浸时形成滤渣的离子方程 式有_____________________。
式有_____________________。
查看答案和解析>>
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:实验题
废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:

已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
查看答案和解析>>
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:实验题
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混 合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和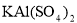 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
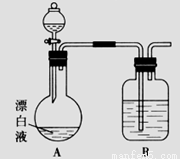
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和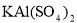 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目: 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:实验题
亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利 用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸

实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名 称为 ;D装置的作用是 。
称为 ;D装置的作用是 。
(2)A中反应的化学方程式是 ;C中反应生成NaNO2的化学方程式是 。
(3)检验C中产物有亚硝酸钠的正确操作是 。
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①.甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是__________(写名称)。
②.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯 ,所以在实验操作①前应增加一步操作,该操作是 。
,所以在实验操作①前应增加一步操作,该操作是 。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是____________mg/kg。
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
右图是常用的危险化学品标志之一,它表示的类型是
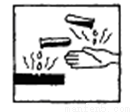
A. 氧化剂 B. 易燃品
C. 放射性物品 D. 腐蚀品
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
下列图示的四种实验操作名称从左到右依次是
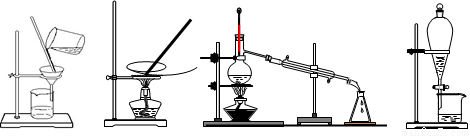
A. 蒸发、蒸馏、过滤、萃取
B. 过滤、蒸馏、蒸发、萃取
C. 过滤、蒸发、蒸馏、分液
D. 萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.32 g O2所含的氧原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com