
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是( )
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
为进一步提高合成氨的生产能力,科研中最有开发价值的是 ( )。
A.研制高温下活性较大的催化剂
B.寻求氮气的新来源
C.研制低温下活性较 大的催化剂
大的催化剂
D.研制耐高温和高压的新材料建造合成塔
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生反应2SO2(g)+O2(g)  2SO3(g) ΔH<0。2 mi
2SO3(g) ΔH<0。2 mi n后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
n后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
反应A+B C分两步进行:①A+B
C分两步进行:①A+B X,②X
X,②X C,反应过程中能量变化如图所示,E1表示反应A+B
C,反应过程中能量变化如图所示,E1表示反应A+B X的活化能。下列有关叙述正确的是( )
X的活化能。下列有关叙述正确的是( )
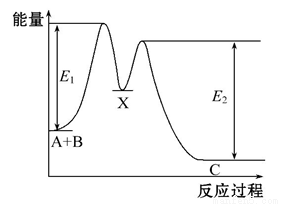
A.E2表示反应X C的活化能
C的活化能
B.X是反应A+B C的催化剂
C的催化剂
C.反应A+B C的ΔH<0
C的ΔH<0
D.加入催化剂可改变反应A+B C的焓变
C的焓变
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是( )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:选择题
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25[o] | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v正<v逆
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:填空题
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g) 3C(g),达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
3C(g),达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题
(1)该反应的平衡常数K随温度升高而 (填“增大”、“减少”或“不变”),该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:填空题
火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65 kJ的热量。
(1)写出肼和过氧化氢的结构式:肼____________过氧化氢____________。
(2)写出反应的热化学方程式:__________________________。
(3)已知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体个很突出的优点是______________。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:填空题
试回答下列各题:
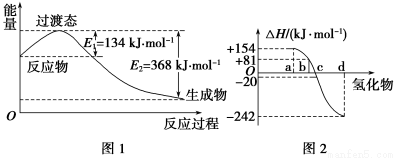
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:____________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写发生分解反应的热化学方程式:_______________________。
(3)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com