
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)  cC(g).反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g).反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是

A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验方案中,不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去CO2气体中的SO2气体 | 将混合气体通入饱和碳酸氢钠溶液,洗气 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 强少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红色 |
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:推断题
短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是____________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的电子式为____________;
(4)E的最高价氧化物的水化物的化学式为____________;
(5)单质C在空气中燃烧的产物存在的化学键类型为 ;其反应化学方程式为 ;
(6)单质E与水反应的离子方程式为____________.
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:推断题
欲确定某无色透明溶液中是否含有下列离子: Cl-、I-、SO42-、HCO3-、NO3-、Na+、Mg2+、Al3+、Fe2+、Ba2+,取适量溶液分别装进①②③④号试管,进行如下实验,请依实验现象回答问题:
①加几滴石蕊试液, 溶液变红色
②浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③加BaCl2溶液, 立即白色沉淀生成。取上层清液,加AgNO3溶液, 出现白色沉淀,且不溶于HNO3
④加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
(1)溶液中肯定存在的离子是 。
(2)溶液中肯定不存在的离子是 。
(3)为进一步确定其他离子,应该补充的实验是 。
(4)写出实验④中所有反应的离子方程式__________________
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:实验题
二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:填空题
“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4.N2O4与NO2转换的热化学方程式为:N2O4(g)  2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由____________________。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示)。影响Kp的因素为___________;
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·P2(NO2),其中k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,v正=__________kPa·s-1;
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为 。
查看答案和解析>>
科目: 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:填空题
能量是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知:C(s)+O2(g)=CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)=H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质。向负极充入燃料气CH4,用空气与 CO2 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中, CO32-移向_________极(填“正”或“负”) ,已知 CH4 发生的电极反应式为 CH4 + 4CO32-―8e-= 5CO2+2H2O,则另一极的电极反应方程式为:
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D 均为铂电极,

A.甲槽中有200ml一定浓度的NaCl与C uSO4混合溶液,理论上两极所得气体的体积随时间变化的关系入上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液NaCl的物质的量浓度 mol/L, CuSO4的物质的量浓度 mol/L。
②t2时所得溶液的pH=___________
B.乙槽CuSO4 溶液200ml。乙槽内电解的总化学方程式________________;
①当 C 极析出 0.64g 物质时,乙杯溶液中生成的硫酸为_________mol。电解后,若使乙池内的溶液完全复原,可向乙池中加入_____________(选填字母标号)
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙杯溶液中加入 0.2mol 的 Cu(OH)2 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为______________。
查看答案和解析>>
科目: 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
A.常温下,反应 C(s) + CO2(g) = 2CO(g)不能自发进行,则该反应的△H > 0
B.合成氨反应 N2(g) + 3H2(g)  2NH3(g) △H < 0,加入催化剂能加快化学反应速率并提高转化率
2NH3(g) △H < 0,加入催化剂能加快化学反应速率并提高转化率
C.甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳”
D.氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高
查看答案和解析>>
科目: 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
设 NA 表示阿伏加德罗常数的值,下列叙述正确的是
A.在反应 KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O 中,Cl2 既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA
B.标准状况下,22.4 L 甲苯中含有的 C—H 键数目为 8NA
C.50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA
D.t℃时,MgCO3 的 Ksp = 4×10-6,则该温度下饱和 MgCO3 溶液中含有的 Mg2+数目为 2×10-3NA
查看答案和解析>>
科目: 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
下列装置合理且能达到实验目的的是
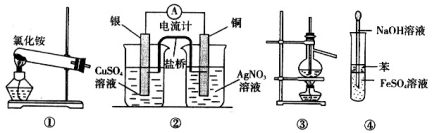
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④可用于 Fe(OH)2 的制取,并能防止 Fe(OH)2 被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com