
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
反应C(s)+H2O(g) CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,升高温度 D.压强不变充入N2 使容器体积增大
使容器体积增大
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
化学反应N2+3H2  2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
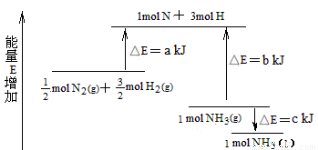
A.N2(g)+3H2(g)  2NH3(l) △H = 2(a-b+c) kJ/mol
2NH3(l) △H = 2(a-b+c) kJ/mol
B.N2(g)+3H2(g)  2NH3(l) △H = 2(a-b-c) kJ/mol
2NH3(l) △H = 2(a-b-c) kJ/mol
C. N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(l) △H = (b+c-a) kJ/mol
NH3(l) △H = (b+c-a) kJ/mol
D. N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g) △H = (a+b) kJ/mol
NH3(g) △H = (a+b) kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
密闭容器中,反应xA(g)+yB(g) zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)=K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)=2 KNO3(s) ΔH3= c kJ·mol-1
KNO3(s) ΔH3= c kJ·mol-1
则x为
A.3a+b-c B.c +3a-b C.a+b-c D.c+a-b
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
下图表示可逆反应mA(g) +nB(s)  xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是
xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是
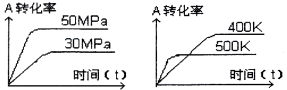
A.m>x,正反应为放热反应
B.m+n<x,正反应为吸热反应
C.m<x,正反应为放热反应
D.m>x,正反应为吸热反应
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
己知反应A(g) + B(g)  C(g) + D(g)的平衡常数K值与温度的关系如下表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如下表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
B.增大压强,正、逆反应速率均加快
 C.该反应正向为放热反应
C.该反应正向为放热反应
D.升高温度,K值增大,平衡正向移动,达到平衡后,B的转化率为50%
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
在体积、温度都相同的条件下,反应2A(g)+2B(g)  C(g)+3D(g)分别从下列两条途径建立平衡:
C(g)+3D(g)分别从下列两条途径建立平衡:
Ⅰ.A、B的起始物质的量均为2 mol;
Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。
以下叙述中不正确的是
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的平均相对分子质量相同
C.达平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vA
D.达平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合气体密度的
查看答案和解析>>
科目: 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A.SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B.SO2为0.25 mol ·L-1
C.SO2、SO3均为0.15 mol ·L-1 D.SO3为0.4 mol ·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com