
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列溶液中Cl-的物质的量浓度最大的是( )
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液
D.300mL 5mol/L KClO3溶液
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
某 离子反应中共有H2O、ClO-、NH4+、H+、N2、
离子反应中共有H2O、ClO-、NH4+、H+、N2、
 Cl-六种微粒。其中C(ClO-) 随反应进行逐渐减小。下列判断错误的是( )
Cl-六种微粒。其中C(ClO-) 随反应进行逐渐减小。下列判断错误的是( )
A.该反应的还原剂是NH4+
B.消耗1mol氧化剂,转移2mol电子
C.氧化剂与还原剂的物质的量之比是2:3
D.反应后溶液酸性明显增强
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列几组标签被腐蚀的试剂①Al2(SO4)3溶液 KOH溶液②NaAlO2溶液 H2SO4溶液③NaHCO3溶液 HCl溶液④AgNO3氨水⑤CuSO4溶液 NaOH溶液 ⑥CCl4 NaCl溶液,不用其他试剂,只用胶头滴管和试管就可以鉴别的是( )
A. ①②③④ B. ①②④⑤⑥
C. ①②③④⑤ D. 全部
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作 | 现象 | |
A | 加入NaOH溶液 | 有红褐色沉淀 |
B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
C | 加入酸性KMnO4溶液 | 紫色褪去 |
D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.氯水和二氧化硫都具有漂白作用,两者漂白原理相同
B.等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等
途径a: ;途径b:
;途径b: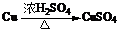
C.1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA
D.从海水中提取物质都必须通过化学反应才能实现
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知溶液中可发生反应:2FeBr2+ Br2= 2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl?和Br? 的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A.2mol·L-1
B.1mol·L-1
C.0.4mol·L-1
D.0.2mol·L-1
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
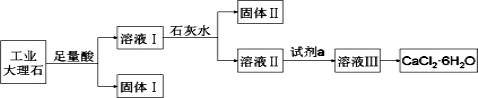
下列说法不正确的是( )
A.固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3
B.使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2-
C.从溶液Ⅲ得到CaCl2·6H2O产品的过程中,须控制好条件防止产物分解
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:实验题
为探究足量锌与浓硫酸的反应,某研究小组进行如下实验。取足量锌与浓H2SO4充分反应,对于制得的气体,有同学认为可能 混有杂质。
混有杂质。
(1)研究小组所制得的气体 中混有的主要杂质气体可能是:__________(填分子式)。产生这种结果的主要原因是: (用化学方程式和必要的文字加以说明)
中混有的主要杂质气体可能是:__________(填分子式)。产生这种结果的主要原因是: (用化学方程式和必要的文字加以说明)
(2 )为证实相关分析,该化学小组的同学设计实验,组装了图1装置,对所制了的气体进行探究.
)为证实相关分析,该化学小组的同学设计实验,组装了图1装置,对所制了的气体进行探究.

①装置C中加入的试剂是:__________;装置D中加入的试剂是:__________.
②装置F中加入的试剂是:__________;U型管G的作用为:______________.
③有同学认为A、B间应增加图中的甲装置,该装置的作用为:______________.
④证明反应生成SO2和H2的实验现象是_________________。
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:填空题
I、请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
___________+___________→___________+___________+___________+H2O
反应物中发生氧化反应的物质是__________,被还原的元素是___________。
反应中1mol氧化剂__________(填“得到”或“失去”)_________mol电子。
II、图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中的NaCl的质量分数。

①如何检验氯化钡溶液已过量______________;
检验沉淀是否洗涤干净所用到的试剂是__________;样品中NaCl的质量分数的数学表达式为___________。
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:填空题
某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四 氯化碳。
氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是: (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com