
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
NA代表阿伏伽德罗常数的值。K35ClO3与H37Cl反应后生成氯气、氯化钾和水。下列说法正确的是
A.生成氯气的相对分子质量为71 B.生成1 mol氯化钾转移6 NA个电子
C.生成氯化钾的摩尔质量为76 g/mol D.1molH37Cl参加反应转移NA个电子
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:
2K2FeO4+16HCl=4KCl+2FeCl3+8H2O+3Q↑,下列说法正确的是
A.可用湿润的淀粉碘化钾试纸检验产物Q
B.K2FeO4在水中的电离方程式为K2FeO4=2K++Fe6++4O2一
C.反应中氧化剂与还原剂的物质的量之比为1:8
D.反应中涉及的6种物质均为电解质
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
有关下列四个常用电化学装置的叙述中,正确的为

A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
探究铜与浓硝酸的反应,下列装置或操作正确的为

A. 用装置①进行铜和浓硫酸的反应 B. 用装置②收集二氧化硫并吸收尾气
C. 用装置③稀释反应后的混合液 D. 用装置④测定余酸的浓度
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
设为阿伏伽德罗常数的值,下列叙述正确的为
A.密闭容器中2molNO 和 1molO2 充分反应,产物的分子数为2NA
B.常温下,1L0.1mol/LNa2CO3 溶液中含有的离子总数为0.3 NA
C.0.1mol铁在0.1molCl2 中充分燃烧,转移的电子数为0.3 NA
D.标况下,1.12L18O3 和1.12L18O2 均含有 0.1 NA个氧原子
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
下列实验室除杂所用试剂和操作均合理的为
选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
A | 碳酸钡(硫酸钡) | 饱和碳酸钠溶液 | 搅拌、过滤 |
B | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
C | FeCl3(FeCl2) | 足量铁粉 | 搅拌、过滤 |
D | HCl(Cl2) | 饱和食盐水 | 洗气 |
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
常温下,关于pH=2的盐酸,下列说法不正确的为
A.溶液中c(H+) = 1.0×10-2 mol·L-1
B.此溶液中由水电离出的c(OH-) = 1.0×10-12 mol·L-1
C.加水稀释100倍后,溶液的pH = 4
D.加入等体积pH = 12的氨水,溶液呈中性
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加;②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同;④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw
A.①②④ B.②④ C.②③ D.①②③④
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:填空题
A、B、D、E、X、Y为元素周期表中六种主族元素,其原子序数依次增大。常温下A2D呈液态;B是大气中含量最高元素; E、X、Y原子最外层电子数相同,且 E的最外层电子数比次外层电子数少1;过渡元素Z与D可形成多种化合物,其中红棕色粉末Z2D3常用作红色油漆和涂料。
请用化学用语回答下列问题:
(1)D在元素周期表中的位置是 。
(2)A与D可形成既含极性键又含非极性键的化合物W。W的水溶液呈弱酸性,常用作无污染的消毒杀菌剂。W的电子式为_________。
(3)向W溶液中加入ZE3,会消弱W的消毒杀菌能力,溶液呈现浅黄色。用化学方程式表示其原因是____________。
(4)由A、B、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性。甲抑制水的电离,则甲的化学式为____________;乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示)____________。
(5)将E2的水溶液加入浅绿色的ZE2溶液中发生反应的离子方程式是____________。
查看答案和解析>>
科目: 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:填空题
在新能源中,氢能将会成为21世纪最理想的能源,但现阶段氢气的主要用于合成氨工业。
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
热量(kJ) | 285.8 | 250.9 | 4910 |
(1)H2燃烧的热化学方程式是__________________。
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是_____________。
Ⅱ.德国人发明了合成氨反应,其原理为: N2(g)+3H2(g) 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1, 在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示。
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1, 在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示。
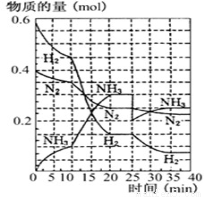
(1)10分钟内用氨气表示该反应的平均速率,V(NH3)= ________
(2)在10-20分钟内氨气浓度变化的原因可能是 (填空题)
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)N2(g)+3H2(g)  2NH3(g);该可逆反应达到平衡的标志 (填字母)
2NH3(g);该可逆反应达到平衡的标志 (填字母)
A.3v正(H2)=2v逆(NH3)
B.混合气体的密度不再随时间变化
C.容器内的压强不再随时间而变化
D.N2、H2、NH3的分子数比为1:3:2
E.单位时间生成nmolN2,同时生成3nmolH2
F.amol 氮氮三键断裂的同时,有6 amol氮氢键合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com