
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
下列操作中能使电离平衡H2O H++OH―,向右移动且溶液呈酸性的是( )
H++OH―,向右移动且溶液呈酸性的是( )
A.将水加热到100℃,使pH=6 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.向水中加入NaHSO4溶液
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为0.1mol·L-1的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是 ( )
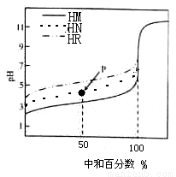
A.三种酸的电离常数关系:KHM>KHN>KHR
B.pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C.滴定至P点时,溶液中:c(Na+)> c(N-)>c(HN)>c(H+)>c(OH-)
D.当中和百分数达100%时,将三种溶液混合后: c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A.醋酸与锌反应放出氢气多
B.从反应开始到结束所需时间盐酸短
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
已知下面三个数据:①7.2×10 -4 ②2.6×10 -4 ③4.9×10 -10 分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO 2 ==HCN+NaNO 2 ,NaNO 2 +HF==HCN+NaF ,NaNO 2 +HF==HNO 2 +NaF,由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2 的电离常数是①
C.HCN的电离常数是② D.HNO2 的电离常数是③
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:填空题
侯氏制碱法曾广泛用于工业制纯碱(Na2CO3),是我国科学家为人类做出的重大贡献.现有25℃时,浓度为0.10mol/LNa2CO3溶液.请回答:
(1)该溶液中c(H+) c(OH﹣) (填“>”、“=”或“<”).
(2)用离子方程式解释(1)的原因: .
(3)下列说法正确的是(填字母) .
a.Na2CO3在水中完全电离
b.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
c.c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
(4)用石墨作电极电解Na2CO3水溶液时,阴极反应式是 .
(5)Na2CO3溶液中的电荷守恒关系式为:
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_____________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
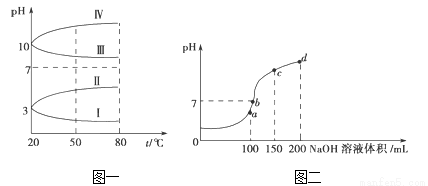
(2)如图1是0.1 mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 mol•L﹣1 NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_________mol•L﹣1(填数值)
(3)室温时,向100 mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是_______________。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:填空题
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为__________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:实验题
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
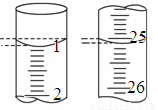
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数为_____________mL。
(4)某学生根据3次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
依据上表数据列式计算该NaOH溶液的物质的量浓度为___________mol/L。(保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com