
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
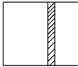 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A. | 物质A、B的转化率之比为a:b | |
| B. | 起始时刻和达平衡后容器中的压强比为(a+b):(a+b-$\frac{n}{2}$) | |
| C. | 若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C | |
| D. | 当v正(A)=2v逆(B)时,可判定反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 化学反应速率与化学平衡
化学反应速率与化学平衡| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| i | 150 | $\frac{1}{3}$ | 0.1 |
| ii | 150 | $\frac{1}{3}$ | 5 |
| iii | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是()
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可冶疗胃酸过多。
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③ ⑤ B.④⑤⑥ C.②③④ D.②④⑥
⑤ B.④⑤⑥ C.②③④ D.②④⑥
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列说法或操作不正确的是()
A. 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸
B. 达到滴定终点后,静置1〜2min再读数,主要是为了防止管壁有液体残留引起误差
C. 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用玻璃棒进行搅拌,准确读取反应前后温度、取2〜3次的实验平均值
D. 某溶液可能含有SO42-和Cl-可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银来检验其中的Cl-
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、HClO、醋酸、SO3
C.KAl (SO4) 2·12H2O、KClO3、NH3·H2O、CH3CH2OH
D.普通玻璃、H2O、Fe (SCN) 3、葡萄糖
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
根据表,下列说法正确的是()
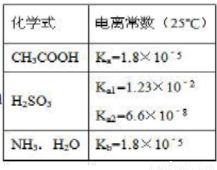
A.25°C时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的
B.Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO3 +2CH3COOH=SO2↑+H2O+2CH3COO-
C. NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2
D.0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa 混合后,溶液中的微粒存在以下关系: c (H+) +c (CH3C OOH) =c (CH3COO-
OOH) =c (CH3COO- ) +2c (OH-)
) +2c (OH-)
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中 金属阳离子情况不可能是( )
A.只含 Cu2 +、Fe2+、Zn2+ B.只含 Zn2+
+、Fe2+、Zn2+ B.只含 Zn2+
C.只含 Fe2+、Zn2+ D.只含 Cu2+、Fe3+、Zn2+
查看答案和解析>>
科目: 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
设 NA为阿伏加罗常数的值,下列说法正确的是( )
NA为阿伏加罗常数的值,下列说法正确的是( )
A.足量Fe在1molCl2中充分燃烧,转移3 NA个电子
B.7.8gNa2O2中阴、阳离子总数为0.3 NA
C.电解精炼铜时,若 转移NA个电子,则阳极减
转移NA个电子,则阳极减 少的质量为32g
少的质量为32g
D.反应KClO3+6HCl=KCl+3 Cl2+3H2O中,若有1molH2O生成,转移电子数为2NA
Cl2+3H2O中,若有1molH2O生成,转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com