
科目: 来源: 题型:选择题
| A. | 凡是组成中含有氢元素的化合物都属于酸 | |
| B. | 凡是组成中含有OH-的化合物都属于碱 | |
| C. | 酸和碱中至少含有一种相同的元素 | |
| D. | 酸和碱中都含有金属阳离子和阴离子 |
查看答案和解析>>
科目: 来源: 题型:解答题
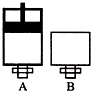 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子的电性 | 电中性 | 两个单位负电荷 | 电中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性:PdCl2>CO2 | |
| B. | 生成22.4LCO2时,转移的电子为2mo1 | |
| C. | 反应中PdCl2被氧化 | |
| D. | CO气体只有在高温下才能表现还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnO2是还原剂 | B. | HCl被氧化 | ||
| C. | MnO2发生氧化反应 | D. | 每反应4molHCl转移4mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔融氢氧化钠固体 | |
| B. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均变质 | |
| D. | 甲醛可用作食品防腐剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某HCl溶液的pH值为2,则溶液中由水电离的c(H+)=10-2mol•L-1 | |
| B. | 0.1 mol•L-1的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) | |
| C. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH>7,则反应后的混合液:c(HA)>C(Na+)>c(A-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O溶于水:Na2O+H2O=2Na++2OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,1.7gNH3所含的电子数为0.8NA | |
| B. | 标准状况下,11.2LSO3所含的氧原子数为1.5NA | |
| C. | 1molSiO2中含有Si-O键的数目为2NA | |
| D. | 1molFe与足量的稀硝酸反应,转移的电子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:填空题
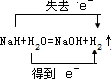 ,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.
,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.查看答案和解析>>
科目: 来源: 题型:选择题
| 成分 | NaOH | Na2CO3 | H2O |
| 质量分数 | 90.4% | 3.8% | 5.8% |
| A. | 2.34 g | B. | 4.68 g | C. | 5.85 g | D. | (2.34-a) g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com