
科目: 来源: 题型:多选题
| A. | 平衡常数K值越大,X的转化率越大 | |
| B. | 达到平衡时,反应速率:v正(X)=2v逆(Z) | |
| C. | 达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数 | |
| D. | 达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 减小C 或D 的浓度 | B. | 增大压强 | ||
| C. | 减小B 的浓度 | D. | 增大 A 或B的浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 | |
| B. | 影响化学平衡常数的因素是温度 | |
| C. | 放热反应不一定能自发进行,而吸热反应也可能自发进行 | |
| D. | 熵增大的反应其焓变一定增大,焓变增大的反应其熵不一定增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
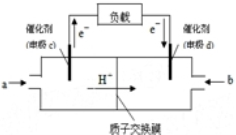 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
科目: 来源: 题型:解答题
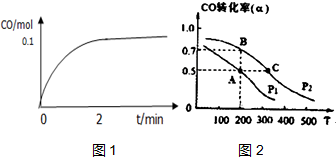 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,18 g H2O中含有的质子数为10 NA | |
| B. | 标准状况下,2.24 L Cl2通入水中,反应转移的电子数为0.1 NA | |
| C. | 常温常压下,53.5 g NH4Cl晶体中含有共价键的数目为4 NA | |
| D. | 常温常压下,2 L 0.5 mol•L-1 硫酸钾溶液中阴、阳离子总数大于3 NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中性重水的pD值为7 | |
| B. | 在1L重水中溶解0.01molDCl,其pD值为4 | |
| C. | 在1L重水中溶解0.01mol NaOD,其pD值为12 | |
| D. | 在100mL 0.25mol/L的DCl重水溶液中加入50mL0.2mol/L的NaOD的重水溶液时,其pD值为1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com