
科目: 来源: 题型:解答题
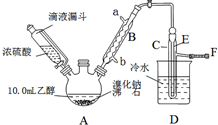 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | FeSO4溶液在空气中变黄色:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 用NaOH溶液吸收NO2气体:3NO2+2NaOH═2NaNO3+NO↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
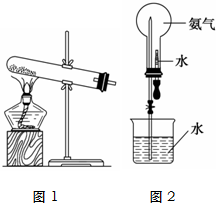 氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:
氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | D. | Fe+CuSO4═Cu+FeSO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸一般要保存棕色试剂瓶中,置于阴凉处,原因是:4HNO3$\frac{\underline{\;见光或受热\;}}{\;}$2NO2↑+O2↑+2H2O | |
| B. | 配制240ml浓度为1 mol•L-1的NaOH溶液,需将NaOH固体放在烧杯中,用托盘天平称取10.00g,选用250ml的容量瓶进行配制 | |
| C. | 常温下可用铁质或铝制容器储运浓硝酸,是因为常温下二者不发生反应 | |
| D. | 铵盐在加热时都会分解产生氨气 |
查看答案和解析>>
科目: 来源: 题型:解答题
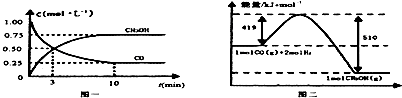
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1 CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL 0.01mol•L-1 H2SO4溶液与10mL 0.01mol•L-1 NaOH溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2L | B. | 0.5L | C. | 0.65L | D. | 0.8L |
查看答案和解析>>
科目: 来源: 题型:解答题
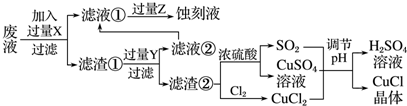
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com