
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 B.
B.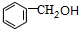 C.
C. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:解答题
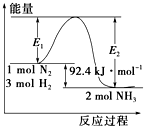 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:| A. | 氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com