
科目: 来源: 题型:选择题
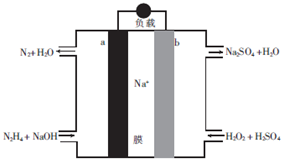
| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液氯和氯水是同一物质 | |
| B. | 红磷在氯气中燃烧产生红色烟雾 | |
| C. | 氯气与水的反应中氯是氧化剂,水是还原剂 | |
| D. | 用氯制漂白粉是为了得到易贮存的漂白剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
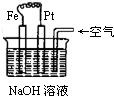
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间观察Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe+2OH-2e-═Fe(OH)3 |
查看答案和解析>>
科目: 来源: 题型:解答题
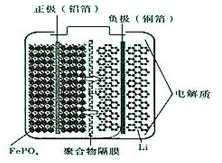 铁是目前人类使用量最大的金属,它能形成多种化合物.
铁是目前人类使用量最大的金属,它能形成多种化合物.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.3Na与O2完全反应生成3.6g产物时失去电子数为0.1NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 标准状况下,11.2LSO3中所含原子数为2NA | |
| D. | 5.6g铁粉与稀硝酸反应失去的电子数一定为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度相等的①NH4C1、②(NH4)2S04、③NH4HS04溶液中,c(NH4+)的大小顺序:②>③>① | |
| B. | 0.2 mol•L-1CH3COOH溶液和0.2 mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(HSO3-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酒精、汽油都是有机溶剂,可以清洗衣服上的油污斑点 | |
| B. | 硫酸可以作铅蓄电池的电解质,也可用于溶解除去锅炉和水壶里的水垢 | |
| C. | 废旧塑料制品、废旧金属制品要回收和利用 | |
| D. | 推广太阳能、风能等新能源技术是施行低碳经济的有效途径 |
查看答案和解析>>
科目: 来源: 题型:解答题
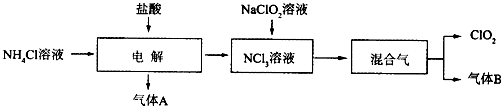
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com