
科目: 来源: 题型:解答题




查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据氧化还原反应的规律,推出强氧化剂遇到强还原剂一定会发生氧化还原反应 | |
| B. | 根据化学反应的规律,推出氢氧化铁可通过化合反应得到 | |
| C. | 根据元素的非金属性较强,其单质也越活泼规律,推出磷单质比N2稳定得多 | |
| D. | 根据CO2通入Ba(NO3)2溶液中无沉淀的规律推测,SO2入Ba(NO3)2溶液中也无沉淀产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在熔融状态下能导电的物质一定是电解质 | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1=0.1mol/L和c2=0.01mol/L,c(H+)分别为amol/L和bmol/L则a=10b | |
| C. | 向0.1mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 | |
| D. | 弱电解质溶液的导电能力可能比强电解质溶液的导电能力强 |
查看答案和解析>>
科目: 来源: 题型:解答题
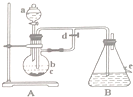 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| C. | 标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L | |
| D. | 7.8g Na2O2中含有的离子总数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CS2、SO3、P4和C6H6都是非极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 在电中性晶体中只要含有阳离子,则一定含有阴离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1=-a kJ•mol-1, ②2H2(g)+O2(g)═2H2O(l)△H2=-b kJ•mol-1, 则a>b,△H1<△H2 | |
| B. | 同温同压下,SO2(g)+2CO(g)═2CO2(g)+S(l)在有无催化剂条件下的△H不同 | |
| C. | 任何酸与碱发生中和反应生成1mol H2O的过程中,能量变化均相同 | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含2.0 g氢氧化钠的稀溶液与稀盐酸完全中和,放出热量2.865 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com