
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O-12e-═2CO2+12H+ | |
| B. | 反应一段时间后,两池溶液的pH均未变化 | |
| C. | 假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol | |
| D. | 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 不可求 |
查看答案和解析>>
科目: 来源: 题型:选择题
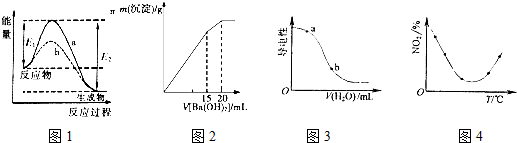
| A. | 图1表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂改变反应的焓变 | |
| B. | 图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| C. | 图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则平衡时c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{9}{16}$ | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 | |
| D. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 蓝矾 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 硝酸 | 苏打 | 氧化钠 | 干冰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com