
科目: 来源: 题型:选择题
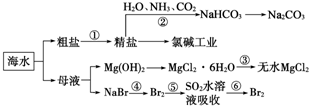
| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
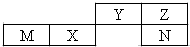 五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )
五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )| A. | 简单离子半径大小:M>N>Z | |
| B. | 最简单气态氢化物的沸点高低:N>Z>Y | |
| C. | M的最高价氧化物可与N的最高价氧化物对应水化物反应 | |
| D. | N单质可与Z的最简单氢化物反应置换出Z单质 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 设法将太阳光聚焦,产生高温,使水分解产生氢气 | |
| B. | 寻找特殊化学物质,使水分解产生氢气,同时释放能量 | |
| C. | 寻找特殊化学物质,用于开发廉价能源以分解水制取氢气 | |
| D. | 构成水的氢气和氧气都是可燃烧的物质,因此可研究在水不分解的情况下,使氢能成为二级能源 |
查看答案和解析>>
科目: 来源: 题型:解答题
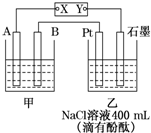 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
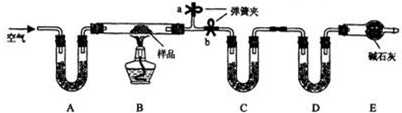
查看答案和解析>>
科目: 来源: 题型:解答题
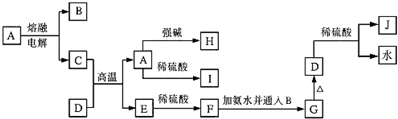
查看答案和解析>>
科目: 来源: 题型:解答题
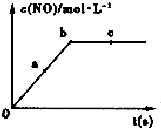 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com