
科目: 来源: 题型:填空题
| 元素 | Mn | Fe | |
| 电离能/mol | I1 | 717 | 758 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
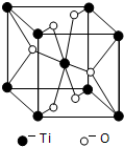
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | |||||||
| ① | |||||||
| Li | C | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||
| K | ⑫ | ⑬ | |||||
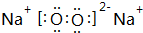 .
.查看答案和解析>>
科目: 来源: 题型:填空题
| X | Y | |
| Z | W |
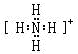 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||

| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目: 来源: 题型:解答题
 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 | |
| D. | A、B、C三种元素形成的化合物,晶体类型一定相同 |
查看答案和解析>>
科目: 来源: 题型:解答题

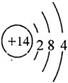 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com