
科目: 来源: 题型:选择题
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
查看答案和解析>>
科目: 来源: 题型:解答题
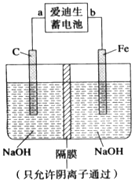 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
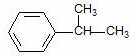 .
.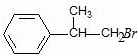 、
、 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
查看答案和解析>>
科目: 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
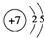 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.查看答案和解析>>
科目: 来源: 题型:解答题
 .
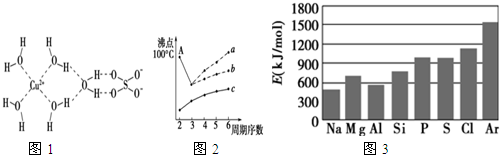
.
查看答案和解析>>
科目: 来源: 题型:解答题
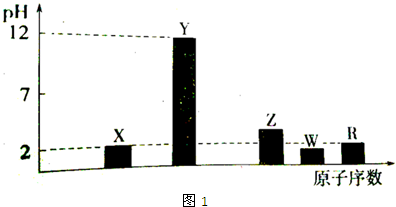
 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
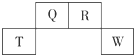 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )| A. | Q的最高价氧化物对应水化物的酸性大于R的最高价氧化物对应水化物的酸性 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | 元素T形成单质的还原性大于元素W形成单质的还原性 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O2和Na2O | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com