
科目: 来源: 题型:选择题
| A. | FeS加入稀硫酸溶液中:FeS+2H+═Fe2++H2S↑ | |
| B. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 铜片跟浓硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O | |
| D. | 酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
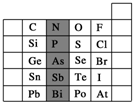 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目: 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 最外层有5个电子的原子不一定是非金属原子 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
查看答案和解析>>
科目: 来源: 题型:解答题
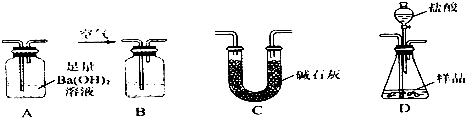
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com