
科目: 来源: 题型:多选题
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食品中大量添加苯甲酸钠等防腐剂,可以有效延长其保持期 | |
| B. | 利用丁达尔效应可区分淀粉溶液和NaCl溶液 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌 | |
| D. | 石油分馏属于化学变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C5H12的烃 | B. | 分子式为C4H10O的醇 | ||
| C. | 分子式为C4H8的烯烃 | D. | 分子式为C3H6O2的酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgO、Al2O3熔点高,可用于耐火材料 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝罐车贮运浓硝酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 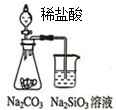 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 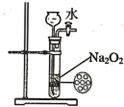 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 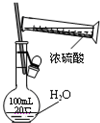 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 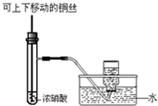 如图为制备并收集少量NO2气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
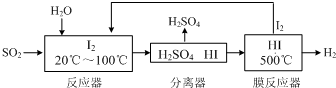
查看答案和解析>>
科目: 来源: 题型:解答题
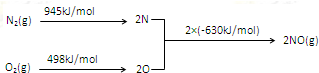
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | I2发生还原反应 | |
| B. | 氧化剂为I2 | |
| C. | 还原剂为KClO3 | |
| D. | 反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com