
科目: 来源: 题型:选择题
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
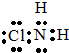 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠、干冰 | B. | 金刚石、晶体硅 | ||
| C. | 碘化氢、溴化氢 | D. | 二氧化硅、二氧化碳 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锂离子电池充电时电池反应为C6Li+Li1-xMO2═LiMO2+C6Li1-x | |
| B. | 电池反应中,锂、锌、银、铅各失去1mol电子,金属锌所消耗的质量最小 | |
| C. | 锂离子电池放电时电池内部Li+向负极移动 | |
| D. | 锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-═C6Li |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuCO3<Cu(OH)2<CuS | C. | CuS<CuCO3<Cu(OH)2 | D. | Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
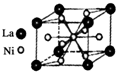 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.查看答案和解析>>
科目: 来源: 题型:填空题
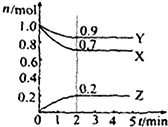 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+的电子排布图: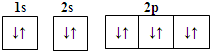 | B. | Na+的结构示意图: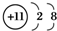 | ||
| C. | Cr的价层电子排布式:3d54s1 | D. | C的电子排布式:1s22s12p3 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 45.8 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 452 | 488 | 614 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com