
科目: 来源: 题型:选择题
| 选项 | W | X | Y | Z | 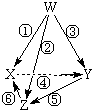 |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| C | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | N2 NH3 NO NO2 | B. | Na Na2O2 NaOH Na2CO3 | ||
| C. | Cu CuSO4 CuCl2 Cu(OH)2 | D. | Al Al2(SO4)3 AlCl3 NaAlO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面矿物油 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 钾(K)一般不用电解法制备,工业上可用Na与熔融KCl反应制K |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(SO2)与c(O2)之比k:k甲=k丙>k乙 | |
| B. | SO3的质量m:m甲=m丙>2m乙 | |
| C. | 容器内压强P:P甲=P丙>2P乙 | |
| D. | 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
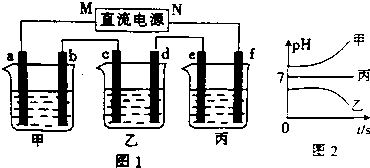
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水是强电解质 | B. | 25℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①③⑤ | C. | ①②③⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
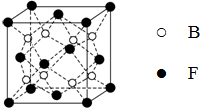 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.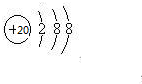 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com