
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
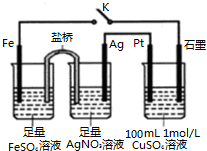
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 闭合K,Pt电极上发生的反应为:4OH--4e-═O2↑+2H2O | |
| C. | 导线中流过0.5mol e-时,加入12.4g CuCO3,CuSO4溶液可恢复原组成 | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目: 来源: 题型:解答题
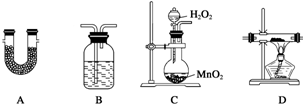
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KNO3 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | .甲溶液含有OH- | B. | .乙溶液含有H+ | C. | 丙溶液含有HCO3- | D. | .丁溶液含有NH4+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
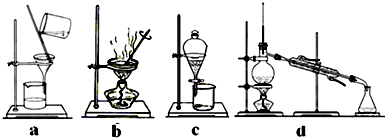
查看答案和解析>>
科目: 来源: 题型:选择题
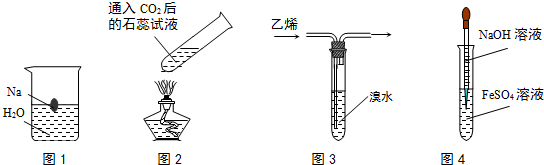
| A. | 图1中溶液颜色变化:无色→红色 | |
| B. | 图2中溶液颜色变化:红色→紫色 | |
| C. | 图3中溴水颜色变化:红棕色→无色 | |
| D. | 图4中生成的沉淀颜色变化:白色→绿色→红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com