
科目: 来源: 题型:选择题
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Cl2+H2O═H++Cl-+HClO | |
| D. | CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe(OH)3胶体粒子的直径在1~100 nm之间 | |
| B. | Fe(OH)3胶体具有丁达尔效应 | |
| C. | Fe(OH)3胶体是均一的分散系 | |
| D. | Fe(OH)3胶体的分散质能通过滤纸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,11.2 L甲烷气体含有的甲烷分子数为0.5NA | |
| B. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数相同 | |
| C. | 标准状况下,11.2 L CO与N2的混合气体与11.2 L O2所含分子数相同,原子数也相同 | |
| D. | 标准状况下,22.4 L CCl4中含共价键数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
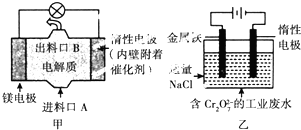
| A. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 | |
| C. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2CH4( g )+4O2( g )═2CO2( g )+4H2O ( l )△H=+890 kJ/mol | |
| B. | CH4+2O2═CO2+H2O△H=-890 kJ/mol | |
| C. | CH4 ( g )+2 O2 ( g )═CO2 ( g )+2 H2O ( l )△H=-890 kJ/mol | |
| D. | $\frac{1}{2}$CH4 ( g )+O2 ( g )═$\frac{1}{2}$CO2 ( g )+H2O ( l )△H=-890 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
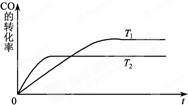 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 请在标有序号的空白处填空:
请在标有序号的空白处填空:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大 | |
| D. | 同一反应在同一时间内,用不同物质来表示的反应速率数值可能不同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4的分子数约为NA个 | |
| B. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA | |
| C. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| D. | 高温高压下,28gN2与6gH2反应,生成的NH3分子数为2nA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com