
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①②⑤ | D. | ③⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
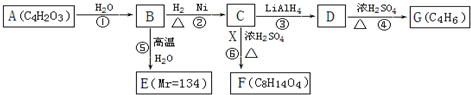
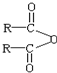 $\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH ,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.
,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.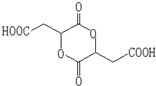 .
.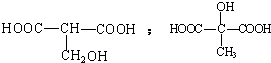 .
.查看答案和解析>>
科目: 来源: 题型:解答题
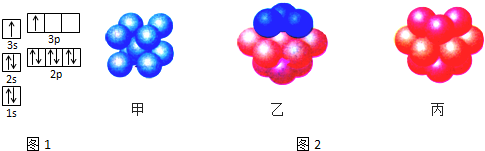
查看答案和解析>>
科目: 来源: 题型:解答题
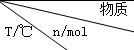 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 第一次实验 | 第二次实验 | |
| 坩埚质量(g) | 14.520 | 14.670 |
| 坩埚质量+晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA | |
| B. | 常温常压下,7.8 g苯中含有双键的数目为0.3 NA | |
| C. | 苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA | |
| D. | 标准状况下,22.4 L甲苯中含C-H键数目为8 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2既是氧化剂又是还原剂 | |
| B. | NaN3中N元素被还原 | |
| C. | 还原产物与氧化产物质量之比为l:15 | |
| D. | 每生成16molN2转移30mole |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 沸点:H2O<H2S<H2Se | B. | 半径:F->Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com