
科目: 来源: 题型:选择题
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 17:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO${\;}_{4}^{-}$ NO${\;}_{3}^{-}$ | ||
| C. | K+ Ca2+ Cl- HCO${\;}_{3}^{-}$ | D. | Cl- Mg2+ Al3+ OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
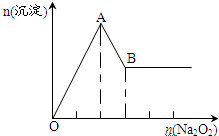 有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验
有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | BaO2是离子化合物,但含有非极性共价键,晶体中阴阳离子个数相等. | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | 电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目: 来源: 题型:选择题
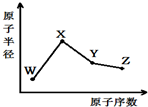
| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
查看答案和解析>>
科目: 来源: 题型:解答题
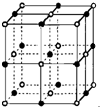 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.查看答案和解析>>
科目: 来源: 题型:选择题
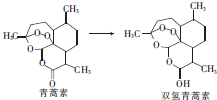
| A. | 青蒿素中氧元素的质量为80g | B. | 双氢青蒿素能发生酯化反应 | ||
| C. | 双氢青蒿素能与溴水发生加成反应 | D. | 青蒿素和双氢青蒿素均含羟基 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 137Cs和133Cs互为同位素 | B. | 单质Cs与水反应非常缓慢 | ||
| C. | 137Cs比133Cs比多个中子 | D. | 137Cs最外层只有1个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com