
科目: 来源: 题型:选择题
| A. | 放电时,负极反应为2n-2e-+20H一═Zn(OH)2 | |
| B. | 充电时,阴极pH增大 | |
| C. | 放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 | |
| D. | 充电时,阳极反应为Fe(OH)3+50H一+3e一=Fe042-+4H20 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 液氨电离达到平衡时,各微粒的浓度保持不变 | |
| C. | 只要不加入其它物质c(NH4+)=c(NH2-) | |
| D. | 液氨中存在NH3、NH4+、NH2-、H2O、NH3•H2O等粒子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工业中使用催化剂,以提高NH3的产量 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | CO2(g)?CO2(aq)△H<0,降温增压可增大二氧化碳气体在水中的溶解度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) | |
| B. | 浓度均为0.1 mol•L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
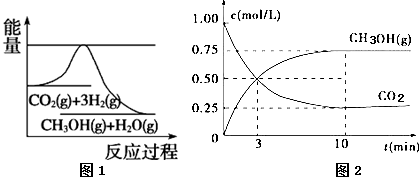
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的盐酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-):c(NH3•H2O)减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
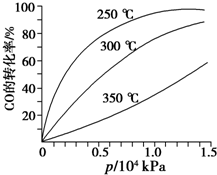 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
 Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是
Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是| A. | 铜做阳极、石墨做阴极,石墨电极上产生氧气 | |
| B. | 铜电极发生的反应为:2Cu-2e-+2OH-=Cu2O+H2O | |
| C. | 在电解过程中OH-向石墨电极移动 | |
| D. | 当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com