
科目: 来源: 题型:解答题
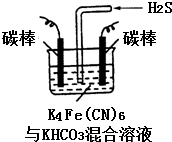 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-141.3kJ•mol-1 | |
| B. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-141.3kJ•mol-1 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6kJ•mol-1 | |
| D. | CO(g)+O2(g)═CO2(g)△H=-141.3kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |
查看答案和解析>>
科目: 来源: 题型:解答题
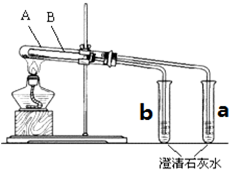 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入硝酸银溶液生成白色沉淀,再加稀硝酸沉淀不溶解,则溶液中一定有Cl- | |
| B. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则溶液中一定有CO${\;}_{3}^{2-}$ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO${\;}_{4}^{2-}$ | |
| D. | 加入氢氧化钠溶液后生成白色沉淀,该白色沉淀迅速变成灰绿色,最终变成红褐色,则溶液中一定含有Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3mol Na2O2与盐酸反应,转移的电子数为0.6NA | |
| B. | 2L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.4NA | |
| C. | 标准状况下,4.48L O2所含有的共用电子对数目为0.2NA | |
| D. | 在常温下,0.3mol NaHSO4固体中含有的离子数目为0.6NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com