
科目: 来源: 题型:选择题
| A. | 周期表中,元素所在的族序数等于原子的最外层电子数 | |
| B. | 同主族元素,随原子序数的增大,原子半径增大,主要原因是核电荷数增大 | |
| C. | 第二周期元素随原子序数的递增,元素原子的第一电离能依次递增 | |
| D. | 第 VIIA族元素从上到下,元素电负性逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 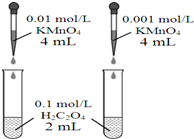 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 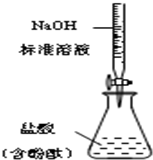 测定盐酸浓度 | |
| C. | 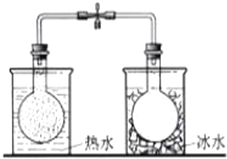 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 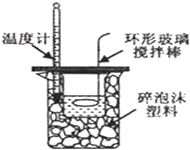 中和热的测定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20mL 2mol•L-1 | B. | 10mL 5mol•L-1 | C. | 20mL 3mol•L-1 | D. | 10mL 3mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
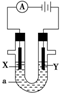 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 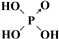 | 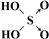 | 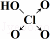 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com