
科目: 来源: 题型:选择题
| A. | 糖类是动、植物所需能量的重要来源,油脂是产生能量最高的营养物质 | |
| B. | 化石燃料的大量使用是产生PM2.5的主要原因之一 | |
| C. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 |
查看答案和解析>>
科目: 来源: 题型:选择题
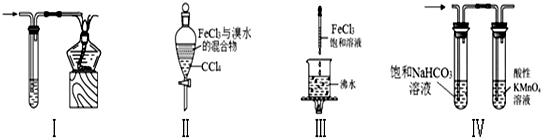
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 银制奖牌久置后表面变暗镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目: 来源: 题型:解答题
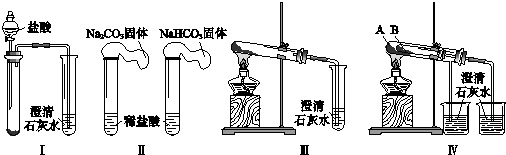
查看答案和解析>>
科目: 来源: 题型:解答题
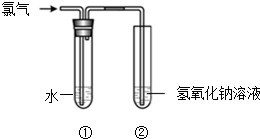 某同学用图所示装置制取氯水并进行相关实验.
某同学用图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目: 来源: 题型:解答题
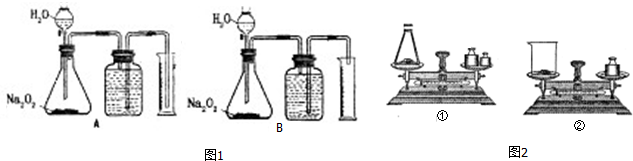
查看答案和解析>>
科目: 来源: 题型:解答题
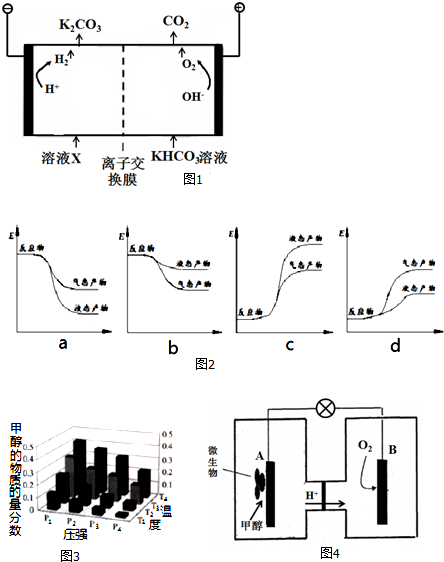
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10g 质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA | |
| B. | 将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L | |
| C. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为7NA | |
| D. | 6g石英晶体中含有的Si-O键数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将材料均匀分散到某液体分散剂中,该分散系可发生丁达尔现象,由此可推测该材料的直径为1~100pm之间 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com