
科目: 来源: 题型:填空题
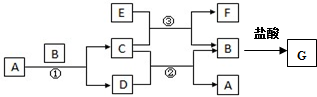
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全部形成AlO2- | B. | 全都为Al(OH)3 | ||
| C. | 一部分为Al(OH)3,一部分为Al3+ | D. | 一部分为Al(OH)3,一部分为AlO2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 定容时,因不慎使液面高于容量的刻度线,需重新配制 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ③⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01 mol•L-1的H2A溶液 | |
| B. | 0.01 mol•L-1NaHA溶液 | |
| C. | 0.02 mol•L-1HCl溶液与0.04 mol•L-1NaHA溶液等体积混合 | |
| D. | 0.02mol•L-1 NaOH溶液0.02 mol•L-1 NaHA溶液等体积混合 |
查看答案和解析>>
科目: 来源: 题型:填空题
 草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:
草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应后所得溶液的溶质是强酸弱碱盐 | |
| B. | 弱酸溶液和强碱溶液反应 | |
| C. | 强酸溶液和弱碱溶液反应 | |
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com