
科目: 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.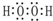 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目: 来源: 题型:解答题
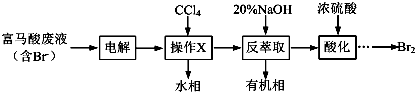

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
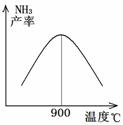 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: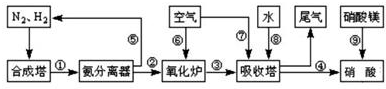
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为黄绿 色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q3-Q2+3 Q1 | B. | Q3+Q2+Q1 | C. | 3Q3-Q2+Q1 | D. | Q2-Q3+3 Q1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 大理石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 稀硫酸和氨水:H++NH3•H2O═NH4++H2O | |
| D. | 碳酸氢钙溶液和盐酸:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com