
科目: 来源: 题型:选择题
| A. | 88.0g 干冰中含有的电子数为8.0NA | |
| B. | 常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | |
| C. | 常温下1.0L0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| D. | 1.2g金刚石中含有的碳碳键数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
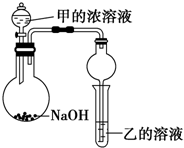 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
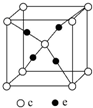 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
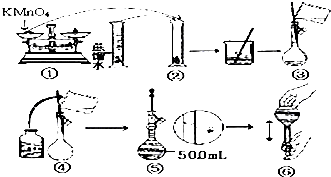 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有PCl5 | B. | 只有PCl3 | ||
| C. | 只有Cl2 | D. | 以上三种物质都有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com