
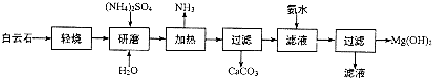
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
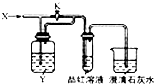 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上用二氧化硅在高温下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 | |
| B. | 手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 | |
| C. | 2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 | |
| D. | 白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成有香味的酯 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目: 来源: 题型:选择题
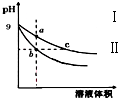 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 负极的电极反应式为Al-3e-→Al3+ | |
| B. | 该电池的总反应式为2Li+FeS═Li2S+Fe | |
| C. | LiAl在电池中作为负极材料,该材料中Li的化合价为+1 | |
| D. | 充电时,阴极发生的电极反应式为Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com