
科目: 来源: 题型:选择题
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2 I2+2H2O | |
| D. | 服用阿司匹林过量出现水杨酸(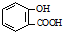 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: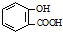 +2 HCO3-→ +2 HCO3-→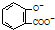 +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目: 来源: 题型:多选题
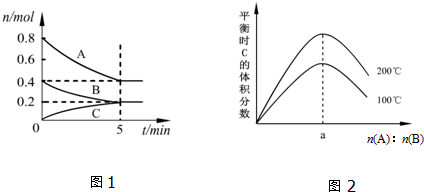
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入1.6molA和0.8molB,达到平衡时,A的转化率大于50% |
查看答案和解析>>
科目: 来源: 题型:解答题
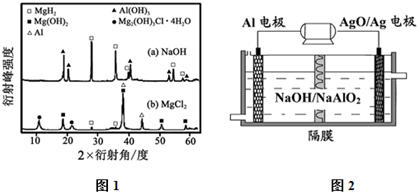
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 欲除去的少量杂质 | 方法 | 反应的离子方程式 |
| (1)Na2CO3溶液中的NaHCO3 | ||
| (2)NaCl溶液中的Na2CO3 | ||
| (3)NaHCO3溶液中的Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
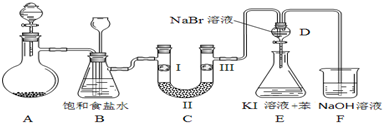
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:解答题
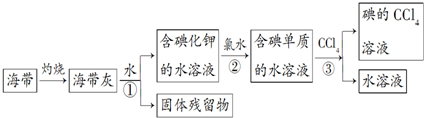
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com