
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
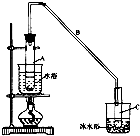 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3种 | B. | 5种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 定性检验C2H5Cl中的氯元素:将C2H5Cl和NaOH溶液混合加热后,再加AgNO3溶液 | |
| B. | 检验汽油是否含有烯烃:取少量汽油,加入碘酒,振荡并观察 | |
| C. | 制乙烯:将无水乙醇加热到170℃ | |
| D. | 蛋白质变性实验:将硫酸铜溶液滴入鸡蛋清溶液中 |
查看答案和解析>>
科目: 来源: 题型:解答题
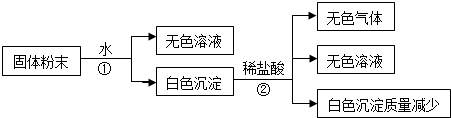
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
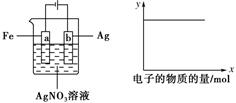
| A. | ①②⑤ | B. | ③④ | C. | ①②④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com