
科目: 来源: 题型:选择题
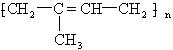 某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )
某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )| A. | 2-甲基-2-丁烯 | B. | 乙烯和丙烯 | ||
| C. | 1,3-T二烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中只存在共价键,一定不含有离子键 | |
| C. | 金属晶体的熔沸点均很高 | |
| D. | 分子晶体中一定含有共价键 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸能使湿润的蓝色石蕊试纸先变红后变黑 | |
| B. | 浓硫酸在常温下可迅速与铜片反应,放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能使铁铝等金属钝化,加热条件下也不反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com